Stan ikry świadczący o stopniu zaawansowania rozwoju zarodkowego powinien być na bieżąco śledzony przez pracowników obsługujących aparaty. Wynika to z potrzeby uwzględniania zmiennej wrażliwości zarodków i dostosowania siły przepływu, naświetlenia i temperatury wody do wymagań związanych z określonym stadium rozwoju zarodkowego. Ponadto, w celu prawidłowego zorganizowania prac w krytycznym okresie wylęgania, trzeba z góry znać termin, w którym mogą pojawić się pierwsze larwy. Zazwyczaj przyjęto posługiwać się w tym celu wskaźnikiem, jaki stanowi suma średnich dobowych temperatur wody przepływającej przez aparaty. Uzyskuje się je z kilku pomiarów powtarzanych w równych odstępach czasu w ciągu dnia i nocy. Codzienne dodawanie średnich -temperatur dobowych daje liczbę stopniodni upływających od rozpoczęcia inkubacji. Wykluwanie się larw szczupaka następuje ma ogół po upływie 120 stopniodni, to znaczy mniej więcej po dwunastu dobach rozwoju zarodkowego w temperaturze wynoszącej średnio 10°. W wyższych i niższych temperaturach liczba stopniodni potrzebnych do osiągnięcia stadium, w którym zarodki są zdolne do wyklucia się, ulega zmianom przedstawionym na rysunku.
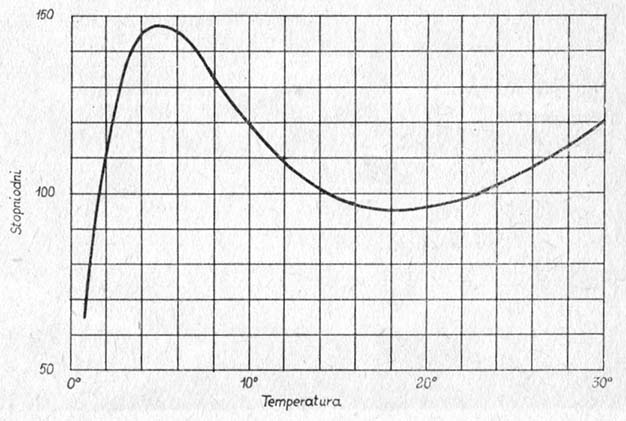 Okres rozwoju ikry szczupaka w stopniodniach, przy różnych temperaturach inkubacji (wg Linidrotha).
Okres rozwoju ikry szczupaka w stopniodniach, przy różnych temperaturach inkubacji (wg Linidrotha).
Określanie faz rozwoju na podstawie skali stopniodni stwarza jednak ryzyko popełnienia błędu, wynikającego stąd, że szybkość procesów zachodzących w jajach zależy nie tylko od średniej temperatury, ale także od zakresu jej wahań, zarówno w ciągu stosunkowo krótkich odcinków czasu, jak i w całym okresie inkubacji, a ponadto od chemicznych właściwości wody zasilającej wylęgarnię. Poważniejszych pomyłek można uniknąć przez kontrolowanie na bieżąco stanu zarodków pod mikroskopem.
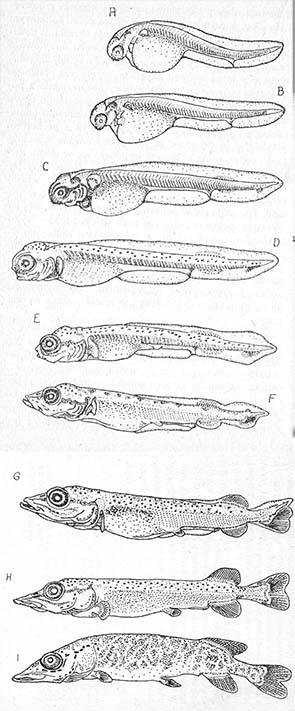
Zgodnie z założeniami najbardziej rozpowszechnionej metody wychowu młodych szczupaków, wykluwanie się larw następuje poza aparatami Weissa. Dlatego – zwykle zaraz po ukazaniu się pigmentu w oczach zarodków (po tzw. zaoczkowamiu ikry) przenosi się ikrę do aparatów kalifornijskich, gdzie spoczywa na siatce, opłukiwana wciąż przepływającą wodą, lecz już -nie unoszona jej prądem.

W czasie przenoszenia należy ponownie oddzielić jaja obumarłe, stosując albo wspomniany już płyn Hofera, albo roztwór soli kuchennej, w którym jaja zdrowe unoszą się na powierzchni, martwe natomiast pozostają przy dnie naczynia. Sakowicz (1939) zaleca przygotować najpierw roztwór o stężeniu 12% (12 g soli na 0,1 1 wody) i dopiero po umieszczeniu w nim ikry dolewać bardziej stężonego aż do uzyskania pożądanej koncentracji — 15,5 %.
W warunkach naturalnych larwy szczupaka tuż po wylęgu szukają wysokiej koncentracji tlenu i przyklejone do otaczających je przedmiotów przechodzą okres spokoju. Podobnie zachowują się w aparatach wylęgowych, znajdując tam jednak warunki o wiele mniej korzystne ze względu na przepływ wody, duże zagęszczenie w niewielkiej przestrzeni i obecność rozkładających się błon jajowych, których usuwanie niepokoi larwy i sprawia, że tworzą masowe zgrupowania w narożnikach aparatu. W efekcie powstają deficyty tlenowe prowadzące do śnięcia larw przez uduszenie. Dlatego wykluwające się larwy należy niezwłocznie przenosić do specjalnie przygotowanych basenów — podchowalników. Używany w tym celu wąż gumowy wciąga jednak wraz z larwami puste błony jajowe, a także jaja, z których larwy jeszcze się nie wykluły. Kraus (1961) zaleca więc umieszczać ikrę przenoszoną do aparatów kalifornijskich nie bezpośrednio na siatce aparatu, lecz w drewnianej ramce o wymiarach tak dobranych, aby między jej krawędziami a ścianami aparatu pozostała odległość wynosząca 5—6 cm.
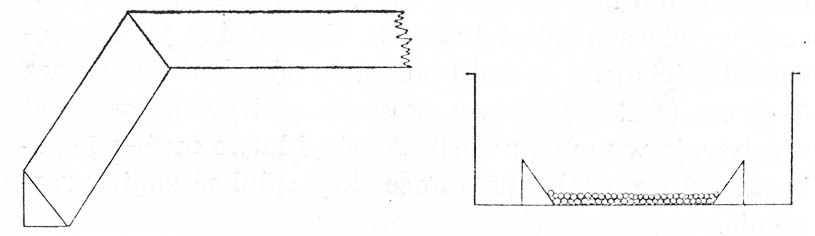 Rysunek. Drewniana ramka do wylęgania ikry szczupaka w aparatach kalifornijskich (wg Krausa).
Rysunek. Drewniana ramka do wylęgania ikry szczupaka w aparatach kalifornijskich (wg Krausa).
Larwy płoszone podrywaniem siatki wypływają w wolną przestrzeń, skąd łatwo można je zebrać, a z pozostałej na ramce ikry spłukać zanieczyszczenia.
Szczerbowski (1965) opisuje udaną próbę przeprowadzenia wylęgu w aparacie Weissa. Po zaoczkowaniu ikrę ponownie umieszczał w słoju (2 litry ikry na 7 litrów wody), gdzie wykluwające się larwy przez dwa dni krążyły unoszone strumieniem wody, którego szybkość przepływu utrzymywano w granicach 3 l/min., a odpływająca woda zabierała puste błony jajowe. Zaletą tej metody — stosowanej także z powodzeniem w Stanach Zjednoczonych (Hiner, 1961) — jest znaczna oszczędność nakładu pracy. Z opisu Hinera wynika, że można przedłużyć czas utrzymania larw w cyrkulacji nawet do pięciu dni, aż zaczną aktywnie przeciwstawiać się prądowi i przyjmować pozycję horyzontalną.
W pierwszej fazie rozwoju larwalnego należy młodym szczupakom zapewnić dobre warunki tlenowe. W celu zwiększenia powierzchni, do której mogłyby się przyczepić, układa się w podchowalnikach gałązki drzew iglastych lub zawiesza się płócienne „fartuszki”. Po upływie około pięciu dni od wyklucia larwy zaczynają swobodnie pływać i choć woreczek żółtkowy nie został jeszcze zresorbowany, są gotowe do przyjmowania pokarmu z zewnątrz. Jeśli wcześniej nie zostały wprowadzone do zbiorników naturalnych, dalsze podohowywanie wymaga intensywnego karmienia. Stosowane przy tym metody można podzielić na trzy grupy: 1 — larwy pozostają w basenach, do których dostarcza się plankton; 2 — umieszcza się je w urządzeniach łowiących plankton samoczynnie; 3 — przeniesione zostają do stawków wcześniej zalanych i nawożonych w celu podniesienia ich żyzności.